Azida
Plantilla:Infotaula compost químicUna azida és un compost químic que conté el grup . Aquest grup es troba lligat a una espècie química de natura molt diversa (un àtom de metall, d’halogen, el radical amoni, un complex, una diversitat de grups i radicals orgànics). Per exemple l'azida de sodi , azida fenílica o azidobenzè o .
L'àcid hidrazoic i la majoria d'altres azides són substàncies explosives, que es descomponen amb l'alliberament de nitrogen mitjançant la més mínima entrada d'energia externa, per exemple, pressió, impacte o calor. Les azides de metalls pesants s'utilitzen, per exemple, en la tecnologia d'explosius, en què serveixen com a detonadors. L'azida de sodi s'aplica als coixins de seguretat,[1] podent-se representar la seva descomposició per la següent equació:[2]
Les azides orgàniques, especialment l'azida metílica, sovint es descomponen de manera explosiva. Tanmateix, malgrat les seves propietats explosives, les azides orgàniques són intermedis valuosos en la síntesi orgànica. Així es fan servir en cicloaddicions, síntesi d'anilines i anilines N-alquil-substituïdes, així com precursors de nitrens. Les reaccions més importants que impliquen azides són: la cicloaddició de Huisgen, la reacció aza-Wittig, el reordenament de Sundberg, la lligadura de Staudinger, els reordenaments de Boyer i Boyer-Aubé, la reordenament de Curtius, el reordenament de Schmidt i el reordenament d'Hemetsberger.[1]
Etimologia
El mot «azida» està format per l'arrel «az–» que prové del francès azote, nom amb el qual el químic francès Antoine L. Lavoisier (1743–1794) anomenà l'element químic nitrogen; i de la terminació «–ida», emprada sovint en química per encunyar noms a partir d'altres. És un mot que proposà el químic alemany Emil Fischer (1852–1919) el 1878 per transformació del mot «amida».[3][4]
Història

La primera azida sintetitzada fou l'azida fenílica el 1864 pel químic alemany Peter Griess (1829–1888)[5] i el 1890 el també alemany Theodor Curtius (1857–1928) preparà l'àcid hidrazoic.[6][7]
Les azides orgàniques foren tema de recerca important als anys 50 i 60 del Plantilla:Segle amb noves aplicacions en la química de les acil, aril i alquil azides. Començà l'interès industrial pels compostos d'azida orgànics amb l'ús d'azides per a la síntesi de composts heterocíclics com ara triazols i tetrazols així com amb el seu ús com a grups funcionals en productes farmacèutics. Així, per exemple, els azidonucleòsids s'estudiaren pel tractament de la sida.[1]
En el Plantilla:Segle ha cobrat força la utilització de la cicloaddició 1,3-dipolar d'alquins amb azides, una aplicació de la reacció de Huisgen en el camp de la química del clic i en la química bioortogonal. La reacció s'ha optimitzat considerablement, especialment en aplicacions bioquímiques, de manera que les grans biomolècules també poden participar en aquest tipus de reaccions. El nombre d'aplicacions d'aquesta reacció augmenta dia a dia[1] i els investigadors que l'han millorat i aplicat en aquests camps han rebut el Premi Nobel de Química de 2022.[8]
Nomenclatura

Les azides inorgàniques s'anomenen com «azida de» i el nom del catió indicant, entre parèntesis, el seu nombre d'oxidació. Per exemple azida de sodi , azida de plom(II) o azida de ferro(III) .
L'azida d'hidrogen s'anomena àcid hidrazoic .
Les azides orgàniques que contenen el grup unit per un àtom de nitrogen a una estructura d’hidrur fonamental s'anomenen:
- En la nomenclatura substitutiva, afegint el prefix «azido–» al nom de l’hidrur fonamental RH. Exemple azidobenzè .
- En la nomenclatura de classe funcional, esmentant el nom de classe azida com a paraula separada abans del nom del grup R. Exemple azida fenílica .
Característiques
Estructura

Els tres àtoms de nitrogen del grup azida es troben enllaçats mitjançant enllaços covalents σ i π. Amb la teoria d'enllaç de valència l'estructura de les azides es pot explicar d'acord amb diverses estructures ressonants que es representen a la figura adjunta. Les dues més importants són les de la part superior i foren proposades per Linus C. Pauling el 1937.[9] Totes elles necessàriament presenten separació de càrregues elèctriques sobre alguns dels tres nitrògens perquè és impossible descriure l'estructura mitjançant la regla de l'octet de Lewis.

L'estructura del grup azida no és lineal sinó que té forma de ziga-zaga. Per a l'azida metílica , el nitrogen central té enllaços amb els altres dos nitrògens que formen un angle de 172,5°. La longitud de l'enllaç entre els dos nitrògens terminals és de 116,2 pm i l'altre enllaç és un poc més llarg, 124,4 pm. El nitrogen enllaçat a la cadena de carbonis té un enllaç σ que forma un angle de 115,2° amb l'altre enllaç del nitrogen i una longitud de 147,2 pm.[1]
Propietats

Les azides iòniques, com ara l'azida de sodi, són relativament estables. Les azides de metalls pesants, com l'azida de plom(II), o les orgàniques, com l'azida metílica, es descomponen fàcilment per efecte de la temperatura, pressió, impacte o fregament, sovint de forma explosiva. Les azides orgàniques, perquè siguin manipulables han de complir que el nombre d'àtoms de nitrogen sigui inferior al de carbonis i que el nombre de carbonis més el nombre d'oxígens dividits pel nombre de nitrògens valgui 3:[10]
L'estabilitat es veu incrementada si el grup es troba enllaçat a grups aromàtics, excepte si estan substituïts en la posició orto.[10]
El grup azida és considerat un pseudohalogen i les azides orgàniques són semblants en molts d'aspectes als hidrocarburs halogenats.[1] Les azides simples d'alquils tenen polaritats, punts d'ebullició i propietats cromatogràfiques molt semblants als derivats de clor i de brom dels hidrocarburs.[11] Els àcids de Brønsted i de Lewis forts, com ara àcid sulfúric, àcid perclòric o trifluorur de bor, extreuen nitrogen de les azides aromàtiques. L'exposició a radiació de curta longitud d'ona dona lloc a la formació de nitrens. Moltes són tòxiques.[10]
Reaccions
Habitualment els nitrògens d'una azida s'enumeren 1, 2 i 3, d'aquesta manera: . El nitrogen , situat a l'extrem del grup, és el més deficient en càrrega elèctrica negativa i, per aquesta raó, és atacat per reactius nucleòfils, rics amb càrrega negativa. Per altra banda, el nitrogen enllaçat a la cadena de carbonis és el que presenta més càrrega negativa i és atacat per reactius electròfils (deficients en càrrega negativa).[1][10]
Cicloaddició 1,3-dipolar de Huisgen

La cicloaddició de Huisgen, descoberta pel químic alemany Rolf Huisgen (1920–2020) és la reacció d'un dipolaròfil (alquens i alquins) amb un compost 1,3-dipolar (azida) que condueix a la formació de composts heterocíclics de cinc membres (1,2,3-triazoles). Malauradament, la cicloaddició d'alquins i azides requereix temperatures elevades i sovint produeix mescles de dos isòmers estructurals quan s'utilitzen alquins asimètrics.[12]

Una variant catalitzada per coure(I) que segueix un mecanisme diferent es pot dur a terme en condicions aquoses, fins i tot a temperatura ambient. A més, mentre que la cicloaddició clàssica sovint dona barreges d'isòmers estructurals, la reacció catalitzada per coure permet la síntesi dels isòmers 1,4-dissubstituïts específicament. Per contra, una reacció catalitzada per ruteni desenvolupada posteriorment dona l'estructurat oposada amb la formació de triazoles 1,5-dissubstituïts. Així, aquestes reaccions catalitzades compleixen plenament amb la definició de la química del clic i s'han centrat en la cicloaddició azida-alquí com a prototip de reacció de clic.[12]
Reacció de Staudinger
La reacció de Staudinger fou descoberta el 1919 pel químic alemany Hermann Staudinger (1881–1965), Premi Nobel de Química del 1953. Les azides es poden convertir en amines per hidrogenació, però una altra possibilitat és la reacció de Staudinger, que és una reducció molt suau d'azides que empra un organofosfà. Com que hi ha una varietat de mètodes per preparar azides fàcilment, la reacció de Staudinger permet utilitzar les azides per preparar amines.[13]
Transposició de Curtius
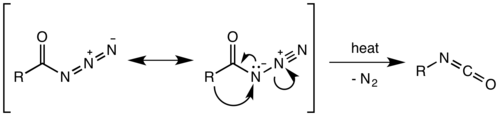
La transposició de Curtius, descoberta al químic alemany Theodor Curtius (1857–1928) és una reordenació intramolecular d'azides carboxíliques per efecte de la calor que produeixen isocianats. Aquests intermedis es poden aïllar o es poden obtenir els seus corresponents productes de reacció o hidròlisi.[14]
Reacció de Schmidt

La reacció de Schmidt, descoberta el 1924 pel químic alemany Karl Friedrich Schmidt (1887–1971), és una reacció orgànica en la qual una azida reacciona amb un derivat del carbonil, generalment un aldehid, cetona o àcid carboxílic, un alcohol terciari o un alquè, en condicions àcides per donar amines, nitrils, amida o imines, amb expulsió de nitrogen.[15]
Preparació
Les azides s'obtenen majoritàriament a partir de l'azida de sodi. El mètode de síntesi més comú per obtenir-la industrialment és el procés Wislicenus dissenyat el 1892 pel químic alemany Johannes Wislicenus (1835–1902), que té lloc en dos passos a partir de sodi metall i amoníac. En el primer pas, l'amoníac es converteix en amida de sodi:[16]

Seguidament l'amida de sodi es fa reaccionar amb monòxid de dinitrogen i s'obté l'azida de sodi, hidròxid de sodi i es recupera l'amoníac.[16]
Altres azides inorgàniques es preparen per reacció de l'azida de sodi. Per exemple l'azida de plom(II) es prepara en dissolució aquosa per reacció de l'azida de sodi amb acetat de plom(II) i s'obté un precipitat d'azida de plom(II).[17] Les azides orgàniques es preparen amb l'azida de sodi per substitució nucleòfila de diferents composts (clorurs, alcohols, epòxids, sulfonats...).[18][19]
Enllaços externs
Referències
Plantilla:Commonscat Plantilla:Autoritat
Plantilla:Identificadors química
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Plantilla:Ref-publicació
- ↑ Plantilla:Ref-publicació
- ↑ Plantilla:Ref-publicació
- ↑ Plantilla:Ref-publicació
- ↑ Plantilla:Ref-publicació
- ↑ Plantilla:Ref-publicació
- ↑ Plantilla:Ref-llibre
- ↑ Plantilla:Ref-web
- ↑ Plantilla:Ref-publicació
- ↑ 10,0 10,1 10,2 10,3 Plantilla:Ref-llibre
- ↑ Plantilla:Ref-llibre
- ↑ 12,0 12,1 Plantilla:Ref-web
- ↑ Plantilla:Ref-web
- ↑ Plantilla:Ref-web
- ↑ Plantilla:Ref-web
- ↑ 16,0 16,1 Plantilla:Ref-llibre
- ↑ Plantilla:Ref-llibre
- ↑ Plantilla:Ref-llibre
- ↑ Plantilla:Ref-publicació